100 나노미터 이하의 크기를 갖는 나노입자는 거대한 표면적과 극미세한 결정립으로부터 기인하는 독특한 기능을 나타내므로 다양한 응용분야에서 적용이 기대되고 있는 소재이다. 특히, 우수한 광학적ㆍ전기적 특성은 물론 기존 마이크론 소재에서는 볼 수 없었던 새로운 물성, 예를 들어 10nm 미만의 크기에서 나타나는 양자점 특성이나, 자기적 초상자성 특성은 전기전자, 정보통신, 환경/에너지 뿐만 아니라 바이오 분야 등에서 새로운 응용을 기대할 수 있다. 이러한 나노입자의 응용은 기존 산업분야의 새로운 패러다임을 유도함으로써, 다양한 산업분야에서 신 수요를 창출하는 블루오션 분야의 핵심 기반소재로 최근 관심의 대상이 되고 있다.
나노입자의 바이오 응용은 2000년대 초, 나노기술의 대두와 더불어 다학제간 협력을 통한 새로운 산업분야를 창출할 수 있는 대표기술로 관심을 받아왔다.
나노입자의 바이오 응용은 기존 약물이나 단백질 입자의 크기를 나노미터 수준으로 작게 제조하여 경구나 피부를 통해 인체 내부로 주입하는 것 외에도, 유기 혹은 무기 나노입자를 이용하여 생물공정 및 진단, 치료에 이용하는 것도 포함된다. 기술의 융합적인 측면에서는 전자보다 후자가 더욱 부가가치가 높은 기술로 분류되고 있으며, 현재 이러한 분야의 연구가 전세계적으로 활발히 진행되고 있다.
최근 융합기술(fusion technology)에 대한 전세계적 관심의 증대와 아울러, 나노기술과 바이오기술을 조합한 나노바이오기술(nanobiotechnology)에 대한 연구가 활발히 진행되고 있다. 특히 나노기술을 이용한 바이오기술 분야의 응용은 단백질 분리정제와 같은 생물화학 공정뿐만 아니라, 질병 진단 및 치료분야에서도 폭넓게 응용될 수 있다. 그 중에서 자성재료를 이용한 온열치료(hyperthermia)는 최근에 관심이 집중되고 있는 분야이다.
온열치료는 신체에 고온의 열을 가하여 질병을 치료하는 기술이다. 신체 조직이 41~45℃ 정도의 열에 노출될 경우 종양과 같이 열에 민감한 조직은 쉽게 손상 받는다. 종양 조직은 가열되면 종양 조직의 복잡한 맥관구조 때문에 혈액 순환이 저하되어 조직 내부 가산성화, 저산소화 영양 부족 상태로 변환된다. 뿐만 아니라 종양 조직의 맥관구조는 정상 조직보다 구조적으로 열을 적게 발산하므로 온열치료에 의해 더 많은 손상을 입게 된다.
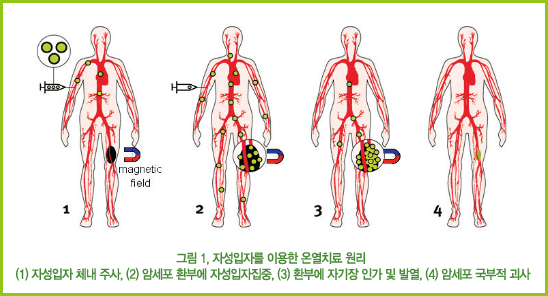
온열치료는 기존의 항암치료인 약물화학요법이 방사선 요법에서 문제가 되고 있는 약물 부작용이나 합병증 발생을 억제할 수 있어 환자에게 신체적 및 정신적 고통을 감소시켜 줄 수 있다. 또 이 기술이 개발·상용화 되면 고가의 항암제 투여에 비해 저렴한 경제적인 방법이다.
온열치료는 전신에 열을 가하는 전신 온열(whole body hyperthermia)방법과 인체의 일부분에만 열을 가하는 국소 온열(local hyperthermia)방법 등 두 가지가 있다. 전신 온열 방법은 1985년 미국 위스콘신의과 대학의 Robins박사 일행을 통해 소개된 방법으로 환자의 전신을 41.8℃까지 1~2시간동안 가온하는 방법이다.
국부적으로 열을 가하는 방법에는 초음파, 마이크로 웨이브, RF 유도가열 등이 이용되고 있으나, 이러한 방법들은 치료시 45℃ 이상의 고온 구역이 발생할 수 있어 암세포 외에도 정상 세포를 손상시킬 수 있다. 또한 사용되는 가온 방법이 모두 고주파영역에 속해 있어 장시간 사용시 인체에 방사선조사와 같은 부작용을 초래할 수 있다. 이러한 단점을 극복하고 인체에 대한 부담을 덜기 위해 유도자기장을 이용한 온열치료가 개발되어 일부 사용되고있다.
자기장을 이용한 온열치료는 1957년 Gilchrist에 의해 처음 보고되었다. 그는 위장간의 암세포를 국부적으로 괴사시키기 위해 림프절 내부에 자성물질을 삽입하고 자기장을 인가함으로써 자성물질의 자기발열에 의해 열을 발생시켰다. 유도 자기장은 체내 조직이 자기장에 대한 투과성이 있기 때문에 지방, 골, 근육에서 선택적으로 과다하게 가온되지 않으며, 또한 자기장은 정상세포나 태아세포 모두 명확한 향반효과가 없음이 확인되었다.
온열치료 응용측면에서 볼 때, 자성입자는 초상자성을 가져야 한다. 일반적으로 강자성체는 인가된 자기장이 제거되더라도 여전히 자성을 가지고 있어 입자들끼리 응집되거나 연결되어 커다란 덩어리를 형성한다. 이렇게 형성된 덩어리는 수 ㎛에 불과한 세포내 미세혈관을 통과하기 어렵고, 또한 통과된다 하더라도 신장에서 걸러지지 않고 체내에 축적됨으로써 또다른 질병을 유발한다. 따라서 온열치료에 사용된 자성입자는 자기장 제거시 자성을 잃고 상자성체로 되어 혈관을 따라 부유하다가 인체 밖으로 배출되어야 한다.
온열치료를 위한 자성입자의 체내 주입에는 다양한 방법이 시도될 수 있다. 전통적으로 외과적 시술을 필요로 하는 매식형이 적용되어 왔으나, 주입과 제거시 외과적 시술에 따른 환자의 고통이 따르며, 정확한 부위로의 매식이 매우 어렵다. 한편 이 시술에 주로 사용되는 Ni-Cu 합금의 경우, 체내 독성 문제와 발열체의 와전류에 의한 이상 고온으로 생체조직의 손상이 초래되기도 한다. 이러한 문제를 극복하기 위하여 최근에는 자성입자를 혈관에 주사하거나 환부에 직접 주입하는 방법이 응용되고 있다. 이러한 주입방법에는 주로 Fe3O4와 같은 인체 무독성이 검증된 산화철 나노입자가 주로 이용되고 있다.
인체 무독성이 검증된 산화철의 경우도 철 이온의 부분적인 침출 우려가 있어 산화철 표면에 유기물 또는 무기물을 코팅하여 사용된다. 무기물로는 인체에 무해하며 이미 많은 생화학 공정에서 이용되고 있는 SiO2나 MgO가 사용되고 있으며, 유기물로는 주로 dextran이 이용되고 있다.
최근 일본에서는 dextran magnetite(DM)을 이용한 온열치료 기술이 개발되어 3년 내에 실용화 할 것이라 밝힌바 있다. DM은 혈액 내에서 굳거나 침전되지 않으며, 특히 암세포가 이 물질을 덮어 증식하는 특성을 살려, 이 물질은 암세포 주위에 주사하면 24시간 이내에 암세포 내에 고정된다. 여기에 전자파를 인가하면 20분 만에 43℃까지 온도가 상승하여 암세포를 국부적으로 괴사시키며 치료 후 서서히 체내 밖으로 배출된다고 보고하였다.
자성 나노입자를 이용한 온열치료 기술은 세계적으로 아직 기초적인 수준에 머물러 있다. 국내뿐만 아니라 해외에서도 관련 연구가 꾸준히 수행되고 있으며 실용화를 위한 노력 또한 계속되고 있다.
자성입자를 이용한 온열치료 기술 개발에 있어 현재 국내외적으로 큰 제한을 받고 있다. 재료, 화공, 생화학, 의학 등과 같은 다학제간 연구의 필요성을 상호 인식하고 있음에도 불구하고 연구개발을 위한 효율적인 협력 체계가 부족한 상황이다. 이는 기술 선진국에서도 마찬가지로 이 기술은 누가 효율적인 협력연구의 인프라를 먼저 구축하고 효율적으로 잘 운용하느냐에 따라 개발 기술을 독점할 수 있는 융합 기술 중의 하나라고 할 수 있다. 따라서 국내에서도 이러한 융합기술의 중요성과 다학제간 협력연구의 필요성을 공감하는 각 분야의 전문가들로 구성된 협력연구체제의 구축이 시급한 상황이며, 이러한 체제 하에서 집중적인 연구를 수행하면 경쟁력있는 선진기술을 선점할 수 있을 것으로 기대된다.
재료공학적 측면에서 이 기술은
(1) 자성나노입자의 제조기술 개발 이외에도 (2) 코팅 및 도핑과 같은 나노입자 복합화 기술, (3) 복합재료의 미세구조 제어기술이나 (4) 입자표면 개질 및 단백질 고정화 기술 등과 같은 핵심기반기술을 동시에 개발할 수 있어 다양한 산업분야에 파급효과가 클 것으로 판단된다.
